《mRNA-LNP疫苗的结构与稳定性》文献解读系列六
作者:AVT 2021.09.06 点击1044次
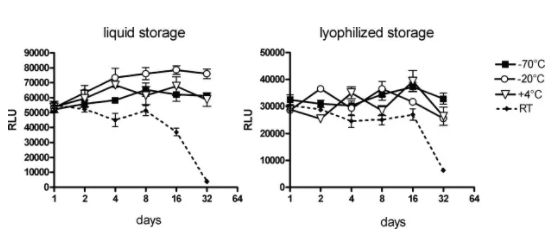
LNP稳定性 除了mRNA 的完整性外,LNP 的稳定性对于 mRNA-LNP 疫苗的质量也至关重要。目前的mRNA疫苗没有披露关于LNP 稳定性测试的数据,但 Onpattro (patisaran) 的siRNA-LNP 制剂保存在2~8°C 之间时具有三年的有效期,同时该产品不能冷冻保存。 Onpattro 的LNP 系统的组成是:可电离的阳离子脂质DLin-MC3-DMA、DSPC、胆固醇、PEG2000-C-DMG(见表 1)(摩尔比 50:10:38.5:1.5),它们在组成上类似于 Comirnaty 和 mRNA-1273的LNP。在一项siRNA-LNPs 的研究中用类脂质306O 13代替DLin-MC3-DMA,样品水溶液在 2°C 、pH 7 的环境下下能稳定储存156 天,其粒径和siRNA包封率没有明显变化。Suzuki 等人的补充研究表明 siRNA-LNP 能在 4°C 环境下稳定储存1.5。总之,这些数据都表明是mRNA 的不稳定,而不是 LNP 的不稳定,导致了当前mRNA-LNP疫苗的储存条件严苛和保质期短。 Fan等人总结了脂质体和 LNP的稳定性及其质量属性。LNP 可以承受化学和物理不稳定性,化学不稳定性包括 LNP 中易水解和氧化的脂质的降解。脂质氧化可能发生在不饱和脂肪酸部分(Comirnaty 和 mRNA-1273 不存在该问题)和胆固醇,氧化可能是PEG2000 -DMG中PEG基团存在杂质导致的结果。除此之外,氧化性杂质也可能导致包封的mRNA 氧化。脂质例如 DSPC 和可电离的阳离子脂质中的羧酸酯键容易受温度和pH依赖性的水解的影响(图 6)。 LNP 稳定性的另一个关键因素是物理稳定性,主要有三种类型的物理不稳定性:包封的药物的聚集、融合和泄漏。 LNP 在储存和流通过程中容易发生 LNP 的聚集,所以为了增加稳定性,LNP 中通常添加PEG化脂质,LNP微粒表面的PEG 分子可防止LNP 聚集。 另一种类型的物理不稳定性主要由于mRNA 的泄漏,这主要影响包封产品的稳定性。值得注意的是,包封率通常 > 90%,并且尚未报道过在储存期间出现mRNA泄露(用RiboGreen监测)的情况。未包封的mRNA(“裸露的mRNA”)几乎不会被细胞摄取;而且它会迅速被降解,因此无法用于翻译。 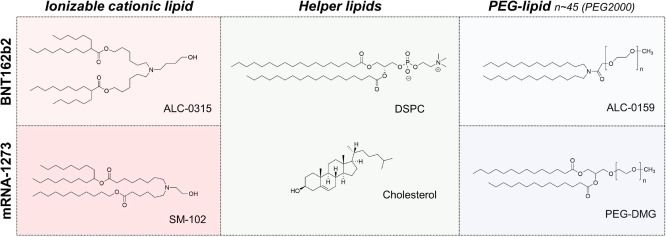 图6 用于 mRNA-LNP疫苗BNT162b2 (Comirnaty) 和 mRNA-1273的脂质。 由于注射 mRNA-LNP疫苗时的超敏反应可能与PEG化脂质有关,因此,已经研究了防止聚集体形成的替代脂质。使用多聚肌氨酸修饰脂质能使脂质递送系统更加稳定,在防止LNP聚集的同时能够减少超敏反应。但是目前仍然需要更多的实验来确定这种 PEG化脂质替代品是否能真正的提高 mRNA 的稳定性(例如不含过氧化物,注:目前使用的PEG脂质由于工艺原因,会有一定的过氧化物杂质,这会引起LNP中其他含有不饱和键的脂质和mRNA的氧化降解)。 分析 LNP 稳定性 Fan 等人在前面提到的文章中对监测 LNP 稳定性的分析方法进行了专业评估。我们推荐感兴趣的读者可以查看相关文献。 mRNA-LNP中哪个成分更不稳定? 迄今为止,已有几项研究考察了在储存期间稳定 mRNA 和稳定 LNP 的方法。然而,两者之中哪一个才是mRNA-LNP稳定性的瓶颈?当mRNA-LNP 制剂未冷冻时,是mRNA 降解?还是 LNP 降解导致稳定性问题?还是 mRNA 与 LNP 的组合? 与mRNA-LNP 系统相比,包封化学修饰且高度稳定的siRNA 分子(例如 Onpattro)的LNP系统具有更长的有效期。这表明当前的稳定性瓶颈不是 LNP,而是 mRNA。 迄今为止,公开资料还没有披露关于 mRNA-LNP 制剂中 mRNA 和 LNP 完整性的研究报告。在研究存储效果的少数研究中,例如 Zhang等人的研究,并没有考察长期储存的稳定性。因此,我们将首先研究裸露的mRNA的长期稳定性,但需要注意的是,这可能与包封在 LNP中的 mRNA 的稳定性有所不同(见下文)。 在Pascolo等人的综述中,裸露的mRNA的水溶液在无RNase的情况下只能在4°C下储存几天。这似乎符合目前对 mRNA 不稳定性的看法。目前关于裸露的mRNA长期稳定性的研究表明,mRNA 需要冷冻或干燥才能保持更长时间的稳定。 Roesler等人2009年的研究表明,编码荧光素酶的mRNA 在无RNA酶存在的条件下,分别以液体或冻干形式在室温下储存,表达效率分别在第8天和第16天开始出现降低,冻干辅料和冻干工艺方面未经优化(见图 7)。同时本研究无法得出关于2-8℃温度下长期储存稳定性的结论,因为稳定性研究只考察了32 天。 Wayment-Steele等人经过基于理论降解速率计算,预测 长度为4000 nt的mRNA在 pH 7.4 和5 °C 的条件下,存储的半衰期为 941 天。他们注意到较长的mRNA序列,例如SAM,更容易发生水解。由于这是jin基于水解降解动力学的理论计算结果,可能会低估 了mRNA的实际降解速率,例如,当存在痕量RNase时,必须对 mRNA 的稳定性进行更多研究才能知道mRNA实际存储的稳定性情况。
图7 通过转染BHK-21细胞中荧光素酶表达效率分析mRNA在水中的稳定性 这些研究表明,在水溶液中 mRNA 可能不如 LNP 稳定。然而,应该重申的是,这两种成分的稳定性考察结果可能与LNP包封mRNA 的情况不同。如前几节所述,mRNA 与可电离的阳离子脂质、胆固醇和水一起位于 LNP 核内部(参见图 4)。这意味着 mRNA 处于水性环境中,因此容易发生水解,其水解的机制可能与溶液中 mRNA水解 的机制相似。然而,另一方面,LNP 内的 mRNA 可能通过疏水、氢键和/或静电相互作用被可电离的脂质包裹。在这种情况下,mRNA 可能比溶解在水溶液中的裸露的mRNA更稳定。在没有进一步研究的情况下,只能得出结论,mRNA 的不稳定性导致了储存条件苛刻。 储存条件不同的原因 当前 mRNA 疫苗的另一个有趣方面是,不同厂家疫苗报告的储存温度和相应的“有效期”差异很大:从 -80°C 到 2-8°C,从几天到几个月。是否因为mRNA 疫苗处的不同导致这种储存条件的差异?又或者,储存条件的差异是否与热稳定性测试结果相关或更可靠的方法有关?这些信息很重要,因为深入了解对稳定性产生积极影响的因素可能是未来设计热稳定mRNA 疫苗的关键突破点。 Acuitas Therapeutics的首席执行官Tom Madden 曾经在采访中表示,Moderna 和 Pfizer/BioNTech mRNA 疫苗可能具有相同的稳定性。后者是否有可能使用更保守的方法来确保稳定性?尽管如此,目前必须在 -60 至 -80 °C 之间储存的Pfizer/BioNTech mRNA-LNP 疫苗很可能也在更高的温度和冷藏条件下进行了稳定性考察,正如CureVac 科学家所做的那样。 此外,稳定性测试中的分析技术在灵敏度上可能不同,验收标准也可能不同。疫苗稳定性研究报告的发布可能对这些疑问作出回答,对此进行比较研究会是很有趣的工作。 文献来源: 1. Abdelwahed, W., Degobert, G., Stainmesse, S., Fessi, H., 2006. Freeze-drying of nanoparticles: Formulation, process and storage considerations. Adv. Drug Deliv. Rev. 58 (15), 1688–1713. https://doi.org/10.1016/j.addr.2006.09.017. 2. Yanez Arteta, M., Kjellman, T., Bartesaghi, S., Wallin, S., Wu, X., Kvist, A.J., Dabkowska, A., Sz′ekely, N., Radulescu, A., Bergenholtz, J., Lindfors, L., 2018. Successful reprogramming of cellular protein production through mRNA delivered by functionalized lipid nanoparticles. Proc. Natl. Acad. Sci. U. S. A. 115 (15), E3351–E3360. https://doi.org/10.1073/pnas.1720542115. 3. Ayat, N.R., Sun, Z., Sun, D.a., Yin, M., Hall, R.C., Vaidya, A.M., Liu, X., Schilb, A.L., Scheidt, J.H., Lu, Z.-R., 2019. Formulation of biocompatible targeted ECO/siRNA nanoparticles with long-term stability for clinical translation of RNAi. Nucleic Acid Ther. 29 (4), 195–207. https://doi.org/10.1089/nat.2019.0784. 4. Baden, L.R., El Sahly, H.M., Essink, B., Kotloff, K., Frey, S., Novak, R., Diemert, D., Spector, S.A., Rouphael, N., Creech, C.B., McGettigan, J., Khetan, S., Segall, N., Solis, J., Brosz, A., Fierro, C., Schwartz, H., Neuzil, K., Corey, L., Gilbert, P., Janes, H., Follmann, D., Marovich, M., Mascola, J., Polakowski, L., Ledgerwood, J., Graham, B.S., Bennett, H., Pajon, R., Knightly, C., Leav, B., Deng, W., Zhou, H., Han, S., Ivarsson, M., Miller, J., Zaks, T., 2021. Efficacy and safety of the mRNA- 1273 SARS-CoV-2 vaccine. N. Engl. J. Med. 384 (5), 403–416. https://doi.org/ 10.1056/NEJMoa2035389. 5. Ball, R.L., Bajaj, P., Whitehead, K.A., 2016. Achieving long-term stability of lipid nanoparticles: examining the effect of pH, temperature, and lyophilization. Int. J. Nanomed. 12, 305–315. https://doi.org/10.2147/IJN.S123062. 6. Bloom, K., van den Berg, F., Arbuthnot, P., 2020. Self-amplifying RNA vaccines for infectious diseases. Gene Ther. 1–13 https://doi.org/10.1038/s41434-020-00204-y. Brader, M.L., Williams, S.J., Banks, J.M., Hui, W.H., Zhou, Z.H., Jin, L., 2021. 7. Encapsulation state of messenger RNA inside lipid nanoparticles. Biophys. J. https:// doi.org/10.1016/j.bpj.2021.03.012. 8. Brisco, M.J., Morley, A.A., 2012. Quantification of RNA integrity and its use for measurement of transcript number. e144–e144 Nucleic Acids Res. 40. https://doi. org/10.1093/nar/gks588. 9.Burke, P.A., Gindy, M.E., Mathre, D.J., Kumar, V., Prud’homme, R.K., 2013. Preparation of Lipid Nanoparticles. US 2013/0037977. 10. Buschmann, M.D., Carrasco, M.J., Alishetty, S., Paige, M., Alameh, M.G., Weissman, D., 2021. Nanomaterial delivery systems for mRNA vaccines. Vaccines 9 (1), 65. https:// doi.org/10.3390/vaccines9010065. 本文来自:AVT | 产品分类
重点推荐产品
|